Die Ösophagusatresie - Übersicht
Einleitung:
Die angeborene Unterbrechung der Speiseröhre, als Oesophagusatresie bezeichnet, ist eine seltene Missbildung. In Österreich kann man erfahrungsgemäß alle 3 - 5.000 Geburten eine derartige Missbildung erwarten. Die Seltenheit dieser Fehlbildung birgt die Gefahr des therapeutischen Qualitätseinbruchs in sich. Eine oft zitierte Lösung dieser Problematik ist die Zentralisierung der Patienten an ein kinderchirurgisches Zentrum, im günstigsten Fall ein Perinatalzentrum mit den Fachdisziplinen Gynäkologie, Pädiatrie, Neonatologie und Kinderchirurgie, wo entsprechend hohe Fallzahlen erreicht werden.
Klassifikation:
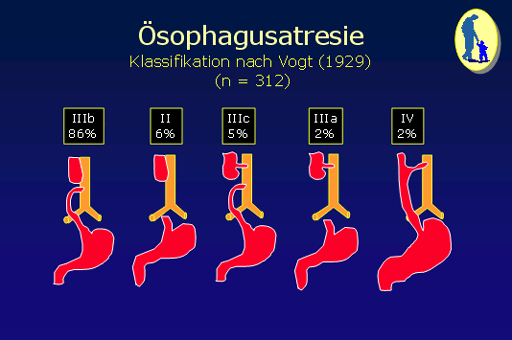
Die nach wie vor gültige Klassifikation der Oesophagusatresien bezieht sich auf Vogt, der die Atresien in die folgenden Typen eingeteilt hat (1): Der häufigste Typ ist der Typ IIIb (86 % während der vergangenen 35 Jahre in Österreich). Dabei findet sich ein relativ großlumiger, sackförmiger und hypertropher, oberer Oesophagusstumpf, der in die obere Thoraxapertur hereinragt und im Bereich des 2. bzw. 3. Thorakalwirbels endet. Der untere Oesophagusstumpf ist atroph und mündet mit einer Oesophagotrachealfistel in die Pars membranacea der Trachea. Wesentlich seltener, nur in 6 % der Fälle, findet sich ein Typ II, wobei oberer und unterer Oesophagusstumpf blind enden und keine Oesophagotrachealfistel vorliegt. Bei diesem Typ der finden sich meist weite Stumpfdistanzen.Typischerweise findet sich im „Abdomen leer“ Bild keine Luft im Intestinaltrakt. Nach dem Typ II folgt der Typ IIIc, der in 5 % der Neugeborenen mit Oesophagusatresie festgestellt werden konnte. Es findet sich sowohl eine obere als auch eine untere oesophagotracheale Fistel. In 2% der Oesophagusatresien findet sich der Typ IIIa, wo nur vom oberen Oesophagusstumpf eine Fistel zur Trachea zieht. Die seltenste Form der Oesophagusatresie ist der Typ IV, die sogenannte H-Fistel. Sie wird in weniger als 2% gesehen und findet sich meist an der oberen Thoraxapertur, sodass eine chirurgische Korrektur von einer collaren Incision aus erfolgen muß. Nachdem die Fistel schräg von der Pars membranacea der Trachea nach caudal zum Oesophagus zieht und die primäre Oesophaguspassage nicht beeinträchtigt ist, kommen Kinder mit dieser Fehlbildung meist nicht als Neugeborene, sondern als Säuglinge bzw. Kleinkinder mit chronischen pulmonal-respiratorischen Problemen zur Vorstellung.
Diagnostik:
Die antenatale sonographische Diagnostik ist schwierig, nachdem in erster Linie nur indirekte Hinweise einer Oesophaguspassagestörung, wie z.B. das Hydramnion (in 60 %, in 85 % bei Oesophagusatresien ohne Fistel) oder eine fehlende Magenblase (in 40 %), gewertet werden können. Bis heute erfolgt der diagnostische Nachweis der Oesophagusatresie postpartal mittels großkalibriger Oesophagussondierung, wobei ein federnder Widerstand auf die Ösopahguspassagestörung hinweist. Die großlumige Magensonde wird, sobald der federnde Widerstand erreicht ist, im Nasenbereich fixiert und das Thoraxröntgen erhärtet die Verdachtsdiagnose des luftgefüllten oberen Oesophagusblindsacks (ev. Gabe von 20 cc Luft über die liegende Magensonde), mit liegender schattengebender Sonde. Es ist wesentlich auch ein abdominales Röntgen durchzuführen, nachdem Luft im Abdomen eine Oesophagotrachealfistel beweist (Typ IIIb, IIIc) und die Luftverteilung im Abdomen Rückschlüsse auf eine zusätzliche mögliche Passagestörung im oberen Gastrointestinaltrakts (z.B. Duondenalatresie) ermöglicht. Die Instillation von wasserlöslichem Kontrastmittel in den oberen Oesophagusstumpf (1 bis 2 ml) ist nur in Ausnahmesituationen notwendig, um z.B. eine obere Fistel (IIIc, IIIa) nachzuweisen. Es sollte auch routinemäßig der Analkanal mit einem Darmrohr sondiert werden, um die ebenfalls in bis zu 15 % vorkommende Analatresie auszuschließen. Wesentlich ist die Ultraschalluntersuchung der Nieren, der ableitenden Harnwege und des Herzens. Die Feststellung eines Perikard- bzw. eines Pleuraergußes weist verstärkt auf die Möglichkeit eines assoziierten cardialen Vitiums hin. Die unmittelbare postpartale Intubation ist nicht zwingend notwendig. Falls eine zunehmende respiratorische Insuffizienz die Intubation und mechanische Beatmung erfordert, muß auf das „air leak“ aufmerksam gemacht werden (IIIb, IIIa, IIIc), wo als Komplikation, besonders bei Frühgeburtlichkeit, Magenperforationen aufgetreten sind (1 - 2 %). Manchmal gelingt es durch Vorschieben des Tubus die Oesophagotrachealfistel abzudecken (Auskultation des Magens, unter mechanischer Ventilation). Es gilt den Beatmungsdruck maximal zu reduzieren z.B. in Form der Surfactant-Applikation (Kurosurf®) bei Lungenunreife. Prinzipiell sollte die große Oesophagotrachealfistel relativ dringlich geschlossen werden. Dazu wurden für die präoperative Versorgung verschiedene unterstützende Methoden publiziert, wobei die tracheoskopische Okklusion mit einem Fogarty-Ballon-Katheter praktikabel und auf der Intensivstation durchführbar ist (2).
Zusätzliche Missbildungen:
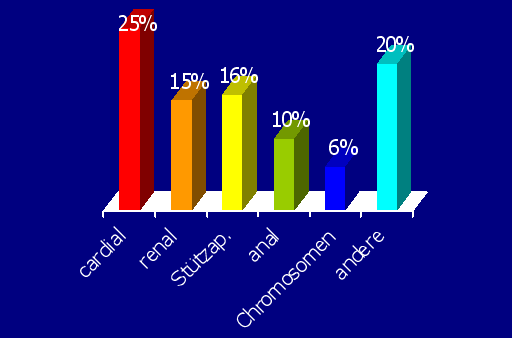
Bei knapp über 50 % der Kinder mit Oesophagusatresie finden sich zusätzliche Missbildungen(3,4). Bei etwa 25 % der Oesophagusatresien mit mehreren Missbildungen rechnen müssen. An erster Stelle, und das nicht nur wegen der prognostischen Relevanz, steht die assoziierte cardiale Missbildung (20-30 %), gefolgt von Missbildungen im Bereich der Extremitäten (20%), im weiteren von den ano-intestinalen Missbildungen (Duodenalatresie bzw. Analatresie, 15 %) und den urogenitalen Missbildungen (15 %). Etwa 30 % der Kinder mit assoziierter cardialer Missbildung zeigen Zeichen der hämodynamischen Insuffizienz. Nur sehr selten (4-9 %) finden sich mit einem Überleben nicht vereinbare Missbildungen (z.B. polycystische Nieren, Trisomie 18, beidseits renale Agenesie). Es ist wesentlich zu betonen, daß sich ein deutlicher Zusammenhang zwischen dem Geburtsgewicht und den zu erwartenden assoziierten Missbildungen nachweisen läßt. So hatten 80 % der Kinder unter 1800g, 60 % der Kinder in der Gewichtsklasse von 1800 bis 2500 g und 40 % der Kinder mit einem Geburtsgewicht von mehr als 2500 g assoziierte Missbildungen. Das heißt, daß man, je niedriger das Geburtsgewicht eines Kindes mit Oesophagusatresie ist, um so eher mit zusätzlichen Missbildungen rechnen muß. Neben den deletären assoziierten Missbildungen (Trisomie 18, polycystische Nieren bds.) hat eine höhergradige Frühgeburtlichkeit bei Neugeborenen mit einem Geburtsgewicht von weniger als 1500 g und die cardiale Missbildungen signifikante prognostische Relevanz (4).
Zusätzliche Missbildungen bei Kindern mit Ösophagusatresie
Nachdem das Neugeborene mit Oesophagusatresie den Speichel nicht schlucken kann, findet sich schaumiger Speichel vor Mund und Nase. Asphyktische Anfälle können durch Aspiration von Speichel infolge Überlaufens des oberen Oesophagusblindsackes bzw. durch Aspiration von Magensaft über die untere Oesophagotrachealfistel (Typ IIIb, 86 % der Fälle) verursacht sein. Die präoperative Aspiration, gefolgt von pneumonischen Infiltraten, steht bei den präoperativen Komplikationen weit an erster Stelle (bis zu 50%). Die sofortige Absaugung und Sondierung des oberen Oesophagusstumpfes mit einer relativ großlumigen, am besten doppellumigen Magensonde und die Oberkörperhochlagerung gehört zu den wesentlichsten Sofortmaßnahmen. Sie stehen eindeutig vor der Intubation.
Die chirurgische Korrektur:
In mehr als zwei Drittel der Patienten ist eine primäre extrapleurale End zu End Anastomose mit gleichzeitigem Fistelverschluß der Ösophagotrachealfistel möglich (5). In einer überstreckten Linksseitenlage erfolgt die Korrektur über eine rechtsseitige posterolaterale Thorakotomie im 4. Intercostalraum. Der obere Oesophagusstumpf wird von den Halsgefäßen intramural versorgt, sodaß auch bei ausgedehnter Mobilisierung die Durchblutung erhalten bleibt. Wie bereits erwähnt, wird durch die gute Mobilisierung auch eine, ev. vorhandene, obere Fistel beim Typ IIIc, die überlicherweise weiter cranial des oberen Oesophagusendes abgeht, identifiziert. Bei forcierter Ventilation sieht man z.B. beim Oesophagusatresie Typ IIIb die rhythmische Blähung des unteren Oesophagusstumpfes. Dadurch wird die Lokalisierung und Präparation erleichtert. Der untere Oesophagusstumpf mündet beim Typ IIIb mit der Oesophagotrachealfistel in die Pars membranacea der Trachea. Nachdem er mit einer Rechtwinkelklemme und einem Gummizügel angeschlungen ist, wird das sogenannte „air leak“ in den Intestinaltrakt verhindert und die Ventilation bessert sich zunehmend. Um eine gute postoperative Funktion zu gewährleisten sollte der untere Oesophagusstumpf zum Erhalt der segmental einstrahlenden Nervus vagus Fasern einerseits und seiner Blutversorgung andererseits, möglichst nicht mobilisiert werden. Nach Anschlingung des unteren Stumpfes wird die Oesophagotrachealfistel durchtrennt und das Fistellumen mit monofilen, resorbierbaren 6.0 Einzelknopfnähten geschlossen. Nachdem sowohl oberer als auch unterer Oesophagusstumpf minimal angefrischt wurden und gut durchblutete Enden vorliegen, gelingt erfahrungsgemäß in etwa 70 % die primäre End-zu-End-Anastomose, die mit allschichtig einreihigen monofilen 6.0 Einzelknopfnähten und transanastomotisch in den Magen vorgeschobener Silikon-Ernährungssonde ausgeführt wird. Der extrapleurale Zugang, meist im zum Mediastinum, bei dem die Pleura mit großteils stumpfer Präparation von der Thoraxwand abgeschoben wird hat Vorteile gegenüber dem transpleuralen Verfahren (6,7). Der Pleuraraum wird nicht eröffnet und im Rahmen einer möglichen Anastomosendehiszenz (ca. 20 %) kann die Entwicklung eines Empyems vermieden werden. Wesentlich ist die vorrangige Mobilisation des oberen Oesophagusstumpfes, der durch die vorgeschobene Magensonde gut von umgebenen mediastinalen Strukturen differenziert werden kann.
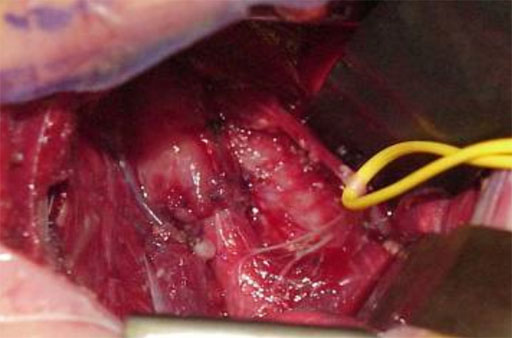
End zu End Anastomose des Ösophagus, der Nervus vagus ist angeschlungen.
In weniger als 20 % finden sich weite Stumpfdistanzen, sowie z.B. bei der Oesophagusatresie Typ II. Nachdem hier keine Oesophagotrachealfistel vorliegt, kann die eigentliche Rekonstruktion des Oesophagus nach längerem präoperativen Intervall erfolgen und als primäre Maßnahme nur eine Gastrostomie angelegt werden. Ob einerseits die propagierte Längsbougierung (Howard and Myers 1965, Hendren 1975) oder die von Rehbein in den 70iger Jahren vorgestellte Fadenelongationsbougierung zwingend notwendig ist, steht heute im Mittelpunkt mancher Diskussion, nachdem 1981 Puri zeigen konnte, daß mit zunehmendem Alter, auch ohne jegliche Manipulation, der obere Oesophagusstumpf wächst und damit die Distanz zwischen beiden Stümpfen spontan kleiner wird (8,9,10). Alternative Techniken zur Behandlung weiter Stumpfdistanzen sind z.B. die Mobilisierung der kleinen Kurvatur und intrathorakale Verlagerung des Magenfundus mit Semi-Fundoplikatio nach Schärli (11). Weiters anzuführen ist die zirkuläre Myotomie und der Oesophagusflap nach Gough (12,13).
Der Oesophagusersatz in Form eines Colon- oder Dünndarminterponats bzw. eines Magenhochzuges ist in weniger als 5 % der Oesophagusatresien notwendig (14,15,16). Es sind eher Ausnahmesituationen, wo der Oesophagus nicht rekonstruiert werden kann (z.B. bei ausgedehnter mediastinaler Vernarbung nach schwerer Mediastinitis; bei extrem weiter Stumpfdistanz oder bei Fehllagen der Aorta). Zwei Drittel aller Kinderchirurgen geben bis heute dem Coloninterponat als Oesophagusersatz den Vorzug. Grundsätzlich kann, und das bestätigen eigene Erfahrungen, der Oesophagus mit dem Colon ascendens und einem Teil des Colon transversums, gestielt an den mesocolischen Gefäßen, als sicherer und relativ problemloser Oesophagusersatz verwendet werden. Man kann auch die Arteria ileocolica durchtrennen und das Ileum mit dem Oesophagusstumpf im Halsbereich anastomosieren. Das Interponat ist üblicherweise isoperistaltisch angelegt und durch die Valvula Bauhini wird der, unter Umständen z.B. im Liegen vorkommende, saure oder gallige Reflux aus dem Gastroduodenalbereich in den Mund vermieden. Alternativ wurde der für den Erwachsenen bereits Anfang des 20igsten Jahrhunderts vorgestellte Magenhochzug erst 1984 von Spitz in London zur Korrektur bestimmter Fälle mit Oesophagusatresie eingeführt. Erweitert durch die Mobilisierung des Duodenums sowie eine Pyloromyotomie kann der mobilisierte Magen mit durchtrennter Vasa gastrica sinistra im originären Oesophagusbett problemlos in den Thorax verlagert werden. Dabei erreicht der Magenfundus die obere Thoraxapertur, wo eine Anastomosierung mit dem oberen Oesophagusstumpf über eine collare Incision durchgeführt werden kann. Als alternative Methode konstruierte Gavriliu aus der großen Kurvatur des Magens einen Schlauch, den er dann transthorakal als Oesophagusersatz verwendete. Diese Technik hat sich bis heute in Österreich nicht wirklich durchsetzen können, was möglicherweise darin begründet ist, daß die langstreckige Naht zur Herstellung des „Tubus“ sowie die collare Anastomose vermehrt insuffizienzgefährdet erscheinen (17).
Postoperative Komplikationen:
Die wesentlichsten postoperativen Komplikationen sind die Anastomosenstenose (20 %), die Anastomoseninsuffizienz (20 %), Schluckbeschwerden für feste Nahrung (bis 50% in den ersten 4 Lebensjahren), die klinisch oftmals symptomlose Trachealinstabilität (80 %), sowie die klinisch relevante Tracheomalazie der gastrooesophageale Reflux und die Thoraxdeformität.
Stenosen im Anastomosenbereich sind prinzipiell, unter Anwendung der heute üblichen allschichtig einreihigen Nahttechnik mit monofilem, resorbierbarem Nahtmaterial, seltener geworden. Die Spannung im Anastomosenbereich (große Stumpfdistanzen), sowie ein saurer gastrooesophagealer Reflux, werden als ätiologische Komponenten für eine Stenosierung diskutiert (18,19). Die Spannung im Anastomosenbereich ist der wesentlichste Faktor für die Entwicklung einer Anastomoseninsuffizienz. Etwa die Hälfte der Anastomoseninsuffizienzen sind im österreichischen Krankengut mit einer oesophagotrachealen Der dorsal gestielte Intercostalmuskelflap stellt eine wesentliche Bereicherung in der Prävention der Anastomoseninsuffizienz und der Rezidiv-Oesophagotrachealfistel dar. Bei Entwicklung einer abszedierenden Mediastinitis empfiehlt sich die Anlegung eines collaren Oesophagostomas, durch welches das Kind das Schlucken nicht verlernt und neben der ausgiebigen Drainage des Mediastinums, der Verschluß des unteren Oesophagusstumpfes. Der Oesophagusersatz kann erfahrungsgemäß im 2. Lebenshalbjahr problemlos durchgeführt werden. Stenosen im Anastomosenbereich sprechen gut auf draht- oder fadengeführte Bougierungen an. Alternativ werden auch Dilatationen bzw. Sprengungen der Stenose mittels Ballondilatation erfolgreich eingesetzt. Eine gewiße Trachealinstabilität wird bei vielen Kindern mit Zustand nach Oesophagusatresie beobachtet. Primär stabilisiert die Oesophagotrachealfistel die Trachea, indem sie die Pars membranacea an ihrer Einmündungsstelle fixiert. Die leichte Trachealinstabilität nach Durchtrennen der oesophagotrachealen Fistel wird üblicherweise gut toleriert. Es gibt jedoch selten Fälle wo die Trachealinstabilität als Tracheomalazie bezeichnet wird und sich durch den Trachealkolaps deutliche Exspirationsprobleme ergeben. Die Tracheomalazie kann sehr gut durch das von Filler angegebene Verfahren der Aortosternopexie behandelt werden (20). Bei diesem Verfahren wird durch eine laterale Thorakotomie ein Teil des Thymus reseziert und der Arcus aortae mit nicht resorbierbaren monofilen Nähten an der Rückseite des Sternums fixiert. Durch die bindegewebige Verbindung zwischen dem Aortenbogen und der Trachea, erfolgt nach dieser Korrekturmaßnahme eine Erweiterung der Trachea nach ventral. „Stents“ wie sie z.B. bei verschiedenen Erkrankungen der Trachea im Erwachsenenalter verwendet und propagiert werden, haben in der Kinderchirurgie praktisch keine Bedeutung. Der gastrooesophageale Reflux wird durch eine Veränderung der Anatomie im Bereich des gastrooesophagealen Übergangs begünstigt. Speziell ist eine Verkürzung des intraabdominellen Oesophagus und die Veränderung des His´schen Winkels als verantwortlich anzusehen. Derartige Veränderungen entstehen bei Oesophagusanastomosen unter Spannung, bzw. bei ausgeprägter Mobilisation des unteren Oesophagusstumpfes. Auch eine Gastrostomie kann die anatomische Situation im gastrooesophagealen Übergangsbereich verändern (21). Refluxe treten vor allem in der ersten 5 postoperativen Jahren auf (22). Mit zunehmendem Alter ist eine Besserung der Oesophagusfunktion und eine Abnahme des gastrooesophagealen Refluxes zu erwarten (23). Im Zusammenhang mit der chronischen Refluxösophagitis ist als extrem seltene Spätkomplikation die maligne Entartung zu nennen (24). Die Thoraxdeformität wird durch eine, sozusagen „kindergerechte“ Thorakotomie, d.h. den M. serratus möglichst caudal zu spalten, den M. latissimus dorsi nicht zu durchtrennen und die Rippe zu belassen, in der Regel vermieden.
Resultate:
Mit Verbesserung der kinderchirurgischen Technik sowie dem extrapleuralen Zugang zum Mediastinum und der Weiterentwicklung der Kinderintensivmedizin, ist es gelungen die Letalität von über 50 % in den 50iger Jahren auf weniger als 10 % zu senken (6,25).
Literatur:
1) Vogt, E.G. (1929) Congenital esophageal atresia. Am J Roentgenol 22: 463-460
2) Filston, H.C., Chitwood, W.R., Schkolne, B. (1982) The Fogarty balloon catheter as an aid to management of the infant with esophageal atresia and tracheoesophageal fistula complicated by severe RDS or pneumonia. J Pediatr Surg 17: 149-151
3) Rokitansky, A., Kolankaya, A., Bichler, B., Mayr, J., Menardi, G. (1994) Analysis of 309 cases of esophageal atresia for associated congenital malformations. Am J Perinatol 11 (2): 123-128
4) Rokitansky, A., Kolankaya, A., Mayr, J., Bichler, B., Menardi, G. (1993) Influence of associated malformations on survival rate of surgically uncomplicated esophageal atresia cases. ActaChir Austr 25: 377-380
5) Haight, C., Towsley, H. (1943) Congenital atresia of the esophagus with tracheoesophageal fistula: extrapleural ligation of fistula and end-to-end anastomosis of esophageal segments. Surg Gynecol Obstet 76: 672-688
6) Bishop, P.J., Klein, M.D., Philippart, A.I., Hixson, D.S., Hertzler, J.H. (1985) Transpleural repair of esophageal atresia without a primary gastrostomy: 240 patients treated between 1951 and 1983. J Pediatr Surg 20: 823-828
7) Holder, T.M., Cloud, D.T., Lewis, J.E. (1964) Esophageal atresia and tracheoesophageal fistula: a survey of its members by the surgical section of the American Academy of Pediatrics. Pediatrics 34: 542-549
8) Hendren, W.H., Hale, J.R. (1975) Electromagnetic bougienage to lengthen esophageal segments in congenital esophageal atresia. N Engl J Med 293: 428-432
9) Howard, R., Myers, N.A. (1965) Esophageal atresia: a technique for elongating the upper pouch. Surgery 58: 725-727
10) Puri, P., Blake, N.S., OtDonnell, B., Guiney, E.J. (1981) Delayed primary anastomosis following spontaneous growth of esophageal segment in esophageal atresia. J Pediatr Surg 16: 180-183
11) Schaerli AF. ; Habe W, editors.Funktionsgerechte Chirurgie der Oesophagusatresie. Stuttgart - New York: Gustav Fischer Verlag, 1991;Postoperative Komplikationen nach Sekundèroperationen. p. 126-33.
12) Brown, A.K., Gough, M.H., Nicholls, G., Tam, P.K.H. (1995) Anterior flap repair of esophageal atresia: A 16-year evaluation. PediatrSurgInt 10: 525-528
13) Livaditi, A. (1973) Esophageal atresia: a method of overbridging large segmental gaps. Z Kinderchir 13: 298-306
14) Ring, W.S., Varco, R.L., LtHeureux, P.R., Foker, J.E. (1982) Esophageal replacement with jejunum in children. An 18 to 33 year follow-up. J Thorac Cardiovasc Surg 83: 918-927
15) Spitz, L. (1984) Gastric transposition via the mediastinal route for infants with long-gap esophageal atresia. J Pediatr Surg 19: 149-154
16) Waterston, D.J., Bonham-Carter, R.E., Aberdeen, E. (1962) Oesophageal atresia, tracheoesophageal fistula - a study of survival in 218 infants. Lancet 1: 819-822
17) Gavriliu, D. (1974) Aspects of esophageal surgery. Curr Probl Surg 12: 36-64
18) Chittmittrapap, S., Spitz, L., Kiely, E.M., Brereton, R.J. (1990) Anastomotic stricture following repair of esophageal atresia. J Pediatr Surg 25: 508-511
19) Myers, N.A., Beasley, S.W., Auldist, A.W. (1990) Secondary esophageal surgery following repair of esophageal atresia with distal tracheoesophageal fistula. J Pediatr Surg 25: 773-777
20) Filler, R.M., Messineo, A., Vinograd, I. (1992) Severe tracheomalacia associated with esophageal atresia: results of surgical treatment. J Pediatr Surg 27: 1136-1141
21) Iinuma, Y., Nitta, K. (1995) Post-gastrostomy gastroesophageal reflux and peptic stricture of the esophagus relieved by releasing the gastrostomy fixation. PediatrSurgInt 10: 494-495
22) Chetcuti P., Phelan PD. (1993) Gastrointestinal morbidity following repair of esophageal atresia and trecheoesophageal fistula. Arch Dis Child 68: 163 – 66.
23) Uray E, Sauer H, Huber A, et al. Habe W, editors. Funktionsgerechte Chirurgie der Oesophagusatresie. Stuttgart - New York: Gustav Fischer Verlag, 1991;Funktionelle Fr×h- und Spètergebnisse bei Kindern mit Oesophagusatresie. p. 241-7.
24) Adzick NS, Fisher JH, Winter HS, Sandler RH, Hendren WH. (1989) Esophageal adenocarcinoma years after esophageal atresia repair. J Ped Surg 24: 741 - 44
25) Louhimo, I., Lindahl, H. (1983) Esophageal atresia: primary results of 500 consecutively treated patients. J Pediatr Surg 18: 217-229
Weiterführende Informationen/Studien:
Totalkorrektur einer langstreckigen Oesophagusatresie (Typ II) am ersten Lebenstag







